체내증식 규명이 치료제 개발 열쇠
신종 코로나바이러스 감염증(COVID-19·코로나19) 확진자가 전 세계에서 200만 명을 넘어섰다. 과학자들은 바이러스의 게놈(유전물질 전체)과 이들이 만드는 단백질을 이해하면 바이러스의 작동 원리를 더 정확히 알아내고 치료제와 백신 개발의 단서를 얻을 수 있을 것으로 보고 있다. 이들 유전자와 단백질은 바이러스가 몸에 침투하는 과정에서 은밀한 안내자가 되기도 하고 확산의 일등공신 역할을 하는 등 치료제와 백신 개발에 중요한 열쇠를 쥐고 있다.
① 바이러스 증식 첫 관문 유전자 ORF1a, ORF1b
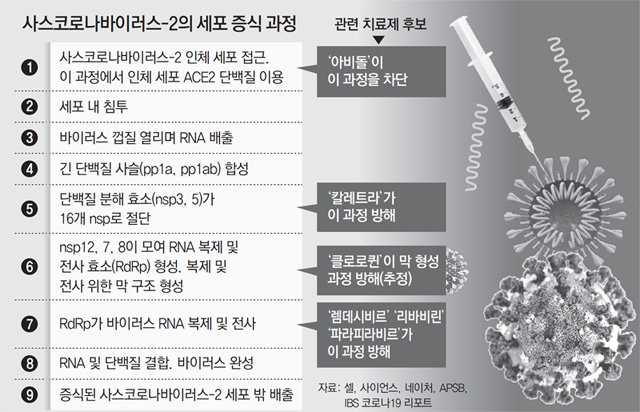
코로나19를 유발하는 사스코로나바이러스-2의 일생은 인체 세포에 ‘침투’하는 과정부터 시작한다. 하지만 이 바이러스의 게놈 맨 앞은 침투가 아니라 침투 직후 과정을 담당하는 유전자 2개로 시작한다. 오픈리딩프레임(ORF)1a와 ORF1b다. ORF는 단백질 생산이 가능한 유전체 영역이라는 뜻이다. 사스코로나바이러스-2는 인체 세포에 들어온 뒤 인체 세포의 자원을 가로채 증식을 시작한다. 마치 다른 새의 둥지에 기생한 뒤 어미의 보살핌을 가로채 부화하는 뻐꾸기 새끼와 같다. 두 유전자는 이런 기생 전략의 첫 단계를 수행한다. 인체 세포가 단백질을 합성할 때 쓰는 단백질을 이용해 ‘폴리펩티드1a(pp1a)’와 ‘폴리펩티드1ab’(pp1ab)라는 긴 단백질 사슬을 만든다.
여기에서 다시 pp1a는 11개, pp1ab는 16개의 작은 비구조단백질(nsp)로 나뉜다. 비구조단백질은 바이러스 몸체를 구성하지 않은 단백질이라는 뜻이다. 이들에는 nsp1∼16이라는 번호가 붙어 있다. 이 중 nsp3과 nsp5는 마치 가위처럼 단백질을 잘게 끊는 단백질 분해 효소다. pp1ab의 나머지 nsp를 잘라내 복제와 증식 같은 중요한 기능에 시동을 건다.
코로나19 치료제를 개발하는 연구진 사이에서는 이 과정이 주요 표적이다. 에이즈 치료제인 항바이러스제 ‘칼레트라’(로피나비르-리토나비르 복합제)도 이 과정을 차단하는 원리를 활용한 약물이다. 중국 연구팀은 이달 9일 nsp5의 구조를 상세히 밝히고 억제 효과가 있는 후보 화합물 6개를 추려 국제학술지 ‘네이처’에 공개했다.
하지만 아직 해결해야 할 과제가 남아 있다. 단백질 가위인 nsp3과 nsp5가 기능을 하려면 먼저 pp1ab에서 잘려 나와야 한다는 점이다. 가위를 만들기 위해 가위가 필요한 것과 같다. 김동완 기초과학연구원(IBS) RNA연구단 연구원은 “이들 단백질이 소량으로 먼저 생성되면서 가위 역할을 수행한다는 가설이 있지만, 아직 밝혀지지 않았다”고 말했다.
인체 세포에는 바이러스가 활동할 ‘멍석’을 깔아주는 역할을 하는 단백질들이 있다. 일종의 막을 형성한 다음 그 안에서 중요한 바이러스 유전물질(RNA)을 복제하도록 자리를 마련해주는 물질이다. 말라리아 치료제 ‘클로로퀸’과 ‘하이드록시클로로퀸’도 바로 이들 단백질이 막을 형성하지 못하도록 방해한다는 가설이 있다는 점에서 코로나19 치료제 후보로 주목받고 있다. 하지만 여전히 추가 연구가 필요하다는 견해도 있다. 명경재 IBS 유전체항상성연구단장(울산과학기술원 특훈교수)은 14일 ‘IBS 코로나19 리포트’에서 “아직 결론을 내리기엔 연구가 부족하다”고 말했다.
④ 사스코로나바이러스-2 찍어내는 ‘공장 단백질’ RdRp
세포에 바이러스가 복제할 공간이 마련되면 다음에는 바이러스 공장이 단계적으로 들어선다. 먼저 nsp13이 뭉쳐 있는 RNA를 풀어주면 nsp7과 nsp8, nsp12 같은 비구조단백질로 구성된 ‘RNA 복제 및 전사 효소(RdRp)’가 뒤이어 작동한다. 바이러스의 가장 중요한 활동인 유전체 복제와 전사를 시작하는 것이다. 복제는 RNA 전체를 통째로 사본으로 만드는 과정이고, 전사는 단백질 생산을 위해 RNA 중 필요한 일부만 골라 ‘부분 사본’(하위게놈)으로 만드는 과정이다. 장혜식 IBS RNA연구단 연구위원(서울대 교수)은 “하위게놈이 종류별로 수백만∼수억 개가 생산된다”고 말했다. 전체 사본을 이용해 새 바이러스의 게놈을 만들고, 부분 사본으로는 여러 가지 바이러스 몸체 단백질을 생산한다.
많은 항바이러스제가 RdRp를 겨냥하고 있다. 렘데시비르나, 리바비린, 파라피라비르는 RNA 염기와 비슷한 모양을 한 ‘불량 재료’ 화합물로, RdRp에 끼어 들어가 복제를 멈춘다. 중국 연구팀은 10일 코로나19 사태 이후 처음으로 가장 상세한 RdRp의 구조를 공개해 향후 치료제 개발 가능성을 높였다.
스파이크 단백질은 바이러스가 인체 세포에 침투하기 위해 활용하는 단백질이다. 인체 세포 표면의 신호 안테나인 에이스투(ACE2) 수용체를 찾은 뒤 결합해 바이러스를 세포 안에 들인다. 중국 연구팀은 3월 국제학술지 사이언스에 사스코로나바이러스-2의 스파이크 단백질은 다른 코로나바이러스보다 수용체 결합력이 높다는 사실을 공개했다. 과학자들은 이것을 코로나19 특유의 강력한 감염력의 원인으로 보고 있다. 치료제 후보 아비돌이 이 과정을 방해한다.
⑥ 바이러스의 단단한 몸을 이루는 단백질 E, M, N
3개의 단백질은 모두 바이러스 안팎의 몸체를 구성한다. M은 바이러스 표면을 이루는 막 단백질이다. E는 바이러스 외피 단백질이다. N은 RNA를 둘러싸는 일종의 보호물질인 뉴클레오캡시드 단백질이다.
⑦ 바이러스 확산과 생존을 돕는 조력자 ORF3a, 6, 7a, 7b, 8
사스코로나바이러스-2 게놈 뒷부분에 모여 있는 작은 유전자에서 만들어진 하위게놈이다. 염기 수가 많아야 수백 개로 적다. 여기에서 만들어진 단백질은 복제된 바이러스가 세포 밖으로 나가는 데 도움을 주는 역할을 한다고 알려져 있다.
⑧ 유령이 된 하위유전체 ORF10
중국 연구팀은 코로나19 바이러스 게놈을 통해 전사체 존재를 예상했지만 김빛내리 IBS RNA연구단장 연구진과 질병관리본부가 9일 국제학술지 셀에 공개한 연구 결과에서는 이 하위게놈이 발견되지 않아 존재하지 않을 가능성이 높다.
윤신영 동아사이언스 기자 ashilla@donga.com
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개



댓글 0