식약처, 정식허가로 전환… 허가심사 기간 대폭 단축
진단시약 전주기 안전관리 정책 수립
포스트 코로나 시대, 진단제품 개발 지원
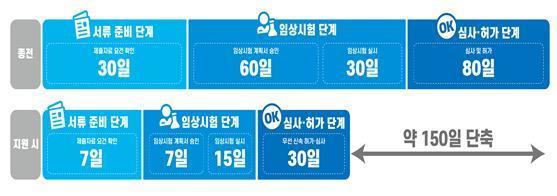
보건당국이 코로나19 진단키트의 긴급사용승인 및 수출용 허가를 정식 허가로 전환하고, 개발 및 허가 기간을 최대 150일 단축한다.
식품의약품안전처는 22일 “정식허가 전환과 체계적인 허가 지원 시스템 구축으로 포스트 코로나 시대에도 K-방역의 명성을 확고히 하겠다”고 밝혔다.
현재 국내에서 긴급사용승인을 받은 코로나19 진단시약은 총 6개 제품이다. 그동안 국내에서 150만명분이 생산됐다. 수출용 허가를 받은 품목은 46개사의 73개 제품(유전자진단 50개, 면역진단 23개)이다.
신청 준비단계에서 맞춤형 컨설팅을 지원해 허가 신청서류 준비기간을 단축(30일→7일)한다. 임상 시험단계에선 가이드 제공과 시험계획서 신속 승인으로 단축(90→22일)되고, 심사·허가단계에선 최대 50일 단축(80→30일 이내)될 예정이다.
식약처는 또 K-방역모델 국제표준화를 추진한다. 관련 부처 및 민간전문가와 협력해 ‘감염병 진단기법’ 관련 표준 2종 및 ‘진단키트 긴급사용승인 절차’ 관련 표준 1종 등 K-방역모델의 국제표준 제정 작업을 추진 중이다.
진단시약 전주기 안전관리 정책도 수립할 계획이다. 지난 1일 체외진단의료기기법 시행에 따라 체외진단기기 특성에 맞춘 전주기 안전관리체계를 도입할 예정이다. ▲맞춤형 안전관리체계 구축 ▲전문성 강화 ▲기술지원을 통한 체외진단의료기기 안전성·유효성 및 산업 경쟁력 확보를 위한 정책을 추진한다.
장기적으론 포스트 코로나 시대에 대비해 국내 진단시약의 품질향상과 임상평가 전문성을 제고할 예정이다.
품질관리에 필요한 표준품 제조·관리·분양, 국내외 기술정보, 최신 임상정보 등을 적기에 제공해 업계의 자체 품질 향상을 도모한다.
임상적 성능 시험 종사자는 전문교육을 이수하도록 하고, 체외진단 분야 핵심인재 양성을 위해 한국의료기기안전정보원의 규제과학전문가 교육과 연계한다.
코로나19 진단에 사용되는 유전자증폭장치, 핵산추출시약 등 주요 체외진단 제품의 국산화가 가능하도록 범부처 전주기 의료기기 연구사업을 통해 적극 지원할 예정이다.
코로나 재확산 >
구독
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개


![[송평인 칼럼]결론 내놓고 논리 꿰맞춘 기교 사법](https://dimg.donga.com/a/464/260/95/1/wps/NEWS/FEED/Donga_Home_News/130511483.1.thumb.jpg)

댓글 0