FDA, 경구약 ‘SER-109’ 판매 승인
2조원대 마이크로바이옴 시장 열려
암-당뇨 등 다양한 질환에 적용될 듯
세계 첫 ‘먹는’ 마이크로바이옴(장내미생물) 치료제가 탄생했다. 미국 식품의약국(FDA)은 지난달 26일(현지시간) 세레스 테라퓨틱스와 네슬레 헬스사이언스가 공동 개발한 마이크로바이옴 경구약 ‘SER-109’의 판매를 승인했다. 이전에는 내시경을 통해 건강한 사람의 대변을 환자의 장에 이식하는 형태로 제약 조건이 많았지만, 경구 치료제가 개발되며 2조 원대 마이크로바이옴 시장이 열릴 것이라는 평가가 나온다.
마이크로바이옴은 장 속 미생물 군집을 뜻한다. 인간의 장 속에는 1000여 종의 유익균과 유해균이 살고 있는데, 마이크로바이옴 치료제는 질병의 원인이 되는 유해균은 줄이고 도움이 되는 유익균은 늘리는 방식으로 장내 미생물 생태계를 안정화하는 치료제다. 적용할 수 있는 질병의 범위가 넓어 기존의 치료 방식으로 완치가 어려웠던 여러 질병의 치료에 도움을 줄 것으로 전망된다.
이번에 승인받은 SER-109의 적응증인 클로스트리디움 디피실 감염증(CDI) 역시 기존의 치료 방식으로는 해결이 어려운 질병이다. CDI는 균이 내뿜는 독소에 의해 설사, 경련, 발열 등의 증상이 나타나는 감염성 질환이다. 초기에는 여러 항생제를 이용해 치료가 가능하지만 쉽게 항생제 내성이 나타나 재발할 경우 적절한 치료법을 찾기 어려웠다. SER-109는 CDI에 대항할 수 있는 유익균을 넣어 질병을 치료한다.
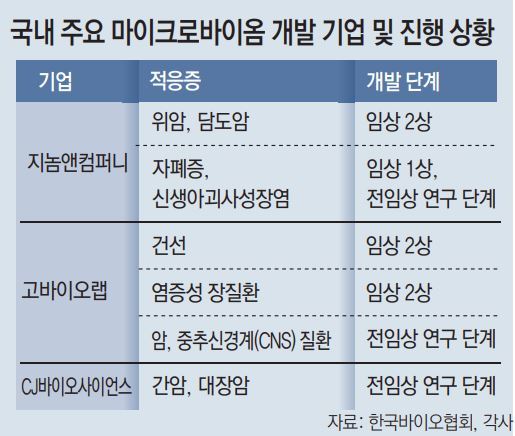
국내에서는 지놈앤컴퍼니, CJ바이오사이언스, 고바이오랩 등 10여 개의 기업이 마이크로바이옴 치료제를 개발하고 있다. 관계부처 역시 관련 사업을 준비 중이다. 과학기술정보통신부, 보건복지부, 산업통상자원부 등 6개 부처는 4000억 원 규모로 ‘국가 마이크로바이옴 이니셔티브’의 예비타당성조사를 추진하고 있다. 한국바이오협회 관계자는 “미국 정부의 경우 2020년 기준 11억8000만 달러를 마이크로바이옴에 투자하며 10년간 투자액이 10배 이상 늘었다”며 “국내도 좀 더 적극적인 지원이 필요하다”고 했다.
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개



댓글 0