美 허가 첫 국산 항암제… 폐암 3세대 치료제
유한 렉라자·얀센 리브리반트 병용요법 허가
EGFR 돌연변이 비소세포폐암 초기 치료제 처방
표준치료제 타그리소(단독요법) 대비 사망위험 30%↓
“효능 차별화로 경쟁력 극대화 위해 병용요법 추진”
조욱제 사장 “글로벌 톱50 제약사 위한 초석 기대”

유한양행이 폐암 치료제로 개발한 국산 31호 신약 ‘렉라자’가 미국에서 병용요법으로 품목허가를 받았다. 바이오시밀러가 아닌 국산 항암제 신약이 미국에서 허가를 받은 것은 이번이 처음이다.
유한양행은 20일 미국 식품의약국(FDA)이 3세대 폐암 신약 ‘렉라자(성분명 레이저티닙 메실산염일수화물, 미국 제품명 라즈클루즈)’와 미국 제약사 존슨앤드존슨(J&J)의 표적이중항체(EGFR·c-MET) 폐암 치료제 ‘리브리반트(아미반타맙)’의 병용요법에 대한 1차 치료제 사용을 승인했다고 밝혔다.
렉라자와 리브리반트 병용요법을 상피세포성장인자수용체(EGFR, Epidermal Growth Factor Receptor) 엑손19 결실 또는 엑손21(L858R) 치환 변이가 확인된 국소 진행성 또는 전이성 비소세포폐암(NSCLC) 성인 환자의 초기 치료제로 사용할 수 있게 된 것이다.
폐암은 전 세계적으로 환자 수가 많고 사망률이 높은 질환으로 가장 큰 항암제 시장을 형성하고 있는 분야다. 작년 기준 글로벌 시장 규모는 약 46조 원에 달하는 것으로 알려졌다. 암세포 크기에 따라 비소세포폐암과 소세포폐암(SCLC)으로 구분되는데 폐암 환자 전체의 80% 이상이 비소세포폐암 환자로 진단받는 추이를 보인다. 또한 폐암 환자에서 EGFR 등 유전자 돌연변이가 확인되면서 이를 표적하는 치료제 개발이 이뤄졌다. 폐암을 유발하는 각각의 유전자 돌연변이를 제거해 암세포 성장을 억제하는 개념으로 이해하면 된다. EGFR 돌연변이는 비소세포폐암 진단을 받은 아시아인에서 상대적으로 많이 발생하는 것으로 전해진다.
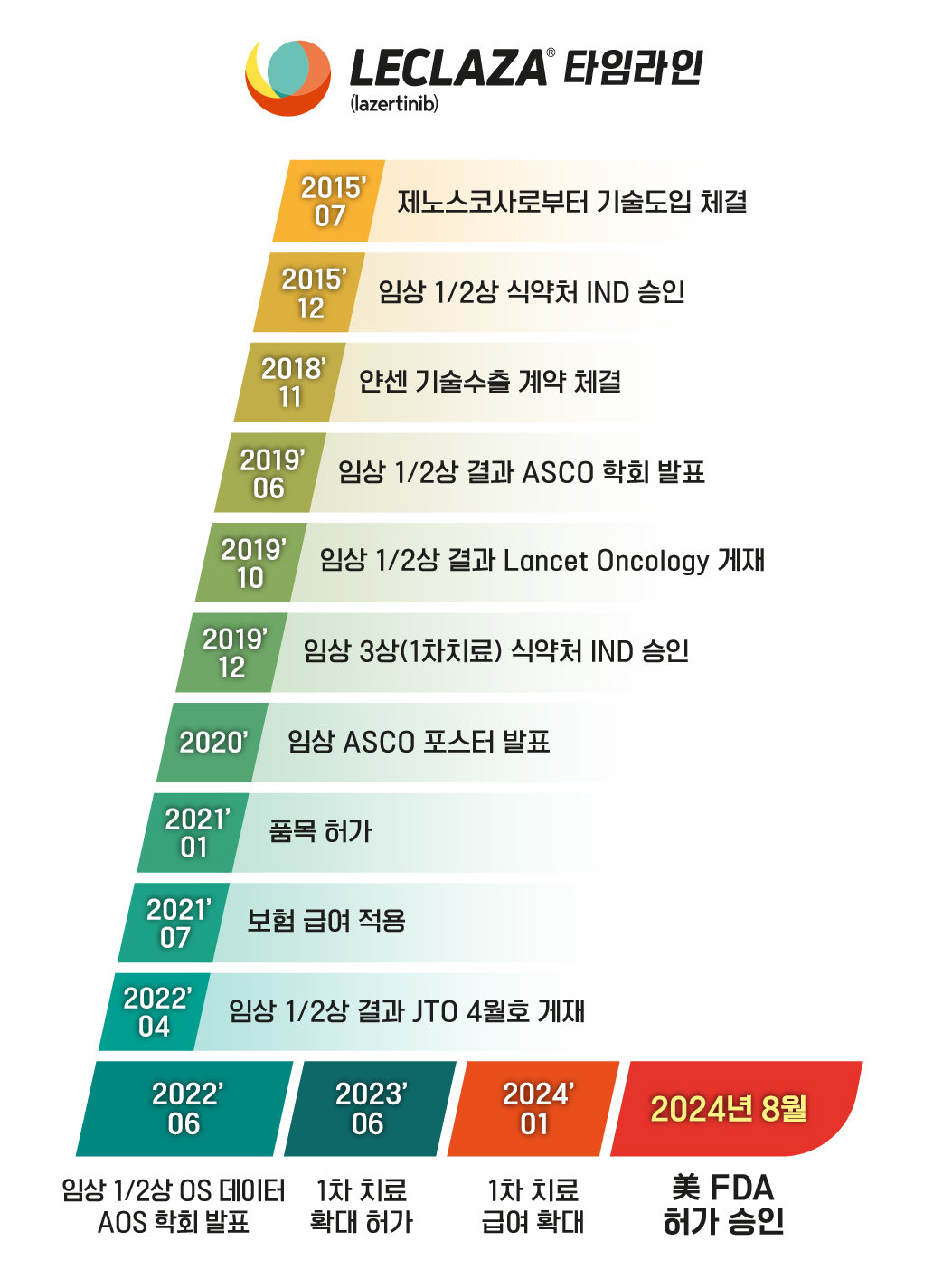
비소세포폐암 치료제 세대는 EGFR 돌연변이와 내성 효능에 따라 구분된다. 3세대 치료제는 1세대와 2세대 치료제 사용 후 내성이 생긴 환자를 치료하기 위한 목적으로 개발됐다. 영국 아스트라제네카의 타그리소(오시머티닙, 2015년 미국 FDA 승인)와 유한양행 렉라자(레이저티닙)가 대표적이다.
이번 승인은 EGFR 변이 NSCLC 환자의 1차 치료제로 처방되고 있는 기존 오시머티닙과 비교해 우월성을 입증한 첫 비화학요법 사례이면서 유일한 다중 표적, 병용요법이라는 점에서 의미가 크다는 평가다.
아스트라제네카의 경우 폐암 치료제 영역에서 타그리소가 보유한 경쟁력과 시장 영향력을 유지하기 위해 타그리소와 화학항암제를 조합한 병용요법 임상을 진행했다. 해당 결과 역시 타그리소 단독요법 대비 우수한 효능을 입증해 FDA로부터 1차 치료제 승인을 획득한 상태다.
레이저티닙 단독요법이 아닌 병용요법으로 품목허가를 추진한 이유는 후발주자이기 때문이라는 분석이 나온다. 먼저 출시돼 시장을 장악한 타그리소보다 월등한 치료 효능으로 경쟁력을 차별화하기 위해서라는 풀이다. 실제로 레이저티닙 단독요법 임상(LASER301)에서는 레이저티닙이 타그리소 대비 다소 우위의 지표를 보였다. 다만 PFS 차이가 약 2개월에 불과해 월등하다고 보기는 어렵다. 전반적으로 효능과 안전성이 비슷한 수준이다. 이런 상황에서 경쟁 제품 대비 장점을 극대화하기 위해 전략적으로 병용요법을 선택했다는 분석이다.
유한양행은 이번 FDA 승인으로 연구·개발 분야 오픈이노베이션이 굵직한 결실을 맺은 것으로 평가하고 있다. 지난 2021년 1월 국산 신약으로 허가 받은 렉라자는 작년 6월 국내 1차 치료제로 허가가 확대된 이후 6개월 만에 건강보험 급여가 적용됐다. 올해 1분기 200억 원대 처방 실적을 기록했고 연내 1000억 원 돌파를 예상하고 있다. 또한 이번 병용요법 허가가 유럽과 중국, 일본 등 다른 국가 승인심사와 국내 처방 확대에 긍정적인 영향을 줄 것으로 기대하고 있다.
조욱제 유한양행 사장은 “이번 렉라자의 FDA 승인은 종착점이 아닌 하나의 통과점”이라며 “유한양행의 ‘글로벌 톱50(TOP50) 제약사’ 달성을 위한 초석이 되길 기대한다”고 말했다.
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개
-
- 추천해요
- 개
![북촌 관광객 ‘야간통금’[횡설수설/우경임]](https://dimg.donga.com/a/464/260/95/1/wps/NEWS/FEED/Donga_Home_News/130360536.1.thumb.jpg)


댓글 0