GC녹십자·한미약품, 파브리병 치료제 ‘LA-GLA’ 공동개발
접수 한 달 만에 임상시험계획(IND) 승인
세계 최초 월 1회 피하주사제로 개발… 치료 편의↑
차세대 파브리병 치료제로 주목… 희귀의약품 지정
기존 2주 간격 정맥주사→월 1회 피하주사

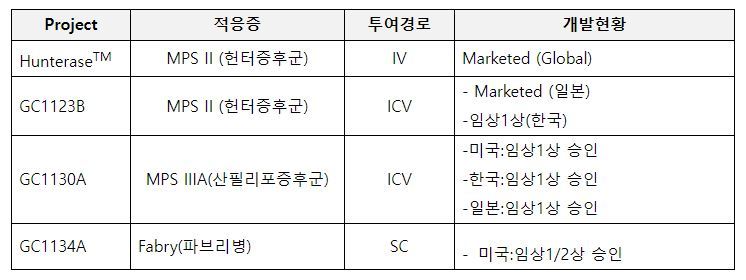
GC녹십자는 한미약품과 공동개발 중인 파브리병 치료제 ‘LA-GLA(개발코드명 GC1134A, HM15421)’가 미국 식품의약국(FDA)으로부터 임상 1·2상 시험계획(IND)을 승인받았다고 2일 밝혔다. 지난 8월 1일 IND를 접수한 후 한 달 만에 승인이 나와 본격적으로 임상에 돌입할 수 있게 됐다.
LA-GLA는 세계 최초 월 1회 피하투여 용법으로 GC녹십자와 한미약품이 공동으로 개발 중인 파브리병 치료 혁신신약이다. 파브리병은 성염색체로 유전되는 진행성 희귀난치질환으로 리소좀축적질환(LSD, Lysosomal Storage Disease) 일종이다. 불필요한 물질을 제거하는 세포 내 소기관 리소좀에서 당지질을 분해하는 효소 ‘알파-갈락토시다아제 A’가 결핍됐을 때 발생한다. 체내 처리되지 못한 당지질이 지속적으로 축적되면서 세포독성 및 염증 반응이 일어나고 이로 인해 다양한 장기가 서서히 손상돼 심하면 사망에 이르는 진행성 희귀난치질환이다.
현재 대부분 파브리병 환자는 유전자 재조합 기술로 개발한 효소를 정맥주사하는 방식인 효소대체요법(ERT, enzyme replacement therapy)으로 치료받고 있다. 해당 1세대 치료제는 2주에 한 번씩 병원에서 오랜 시간 정맥주사를 맞아야 하는 불편이 있다. 여기에 정맥 주입에 따른 치료 부담과 진행성 신장질환 억제에 대한 부족한 효능 등의 한계도 있다.
GC녹십자 관계자는 “FDA에서 요구하는 최신 임상 프로토콜을 반영하고 GC녹십자와 한미약품의 전문화된 기술력을 집약해 협업한 결과 신속하게 임상 단계에 진입할 수 있었다”며 “리소좀축적질환 치료제 개발 경험과 지식, 노하우를 바탕으로 파브리병으로 고통 받는 환자들에게 새로운 치료옵션을 제공할 수 있도록 신약 개발에 최선을 다할 것”이라고 말했다.
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개
-
- 추천해요
- 개
![“1초 스캔으로 잔반 줄이고 건강 지키는 마법”[허진석의 톡톡 스타트업]](https://dimg.donga.com/a/464/260/95/1/wps/NEWS/FEED/Donga_Home_News/130486662.1.thumb.jpg)


댓글 0