[과학&기술의 최전선/바이오의약]<2> 재생의학의 꿈, 줄기세포 치료
지난달 30일 이낙연 국무총리가 ‘제2차 규제혁파를 위한 현장대화’를 주재하면서 “배아줄기세포 연구 분야에서 연구 허용 질환 범위를 선진국 수준으로 허용할 것을 검토하겠다”고 밝혔다. 이 말은 생명윤리 및 안전에 관한 법률(생명윤리법) 제29조 1항에 명시된 ‘잔여배아 연구가 가능한 희귀·난치병’의 범위를 확대할 의지를 정부가 갖고 있다는 뜻으로 풀이된다. 하지만 원래 의미와 별도로 ‘줄기세포’라는 표현이 언급되면서 ‘줄기세포치료’에 대한 관심 역시 높아지고 있다.
줄기세포치료제는 ‘재생의학’의 첨단에 서 있는 기술이다. 줄기세포는 우리 몸에 있는 세포 중 하나로, 피부세포나 신경세포 등 실제로 우리 몸을 구성하는 조직 세포로 ‘변신’할 수 있는 일종의 원시 세포다. 자신을 복제해 똑같은 세포를 만드는 능력도 뛰어나다. 줄기세포치료제는 줄기세포의 변신 능력과 복제 능력을 직접 이용해 개발한 치료제로, 원하는 조직에 줄기세포를 공급해 새로운 세포가 태어나게 유도한다.
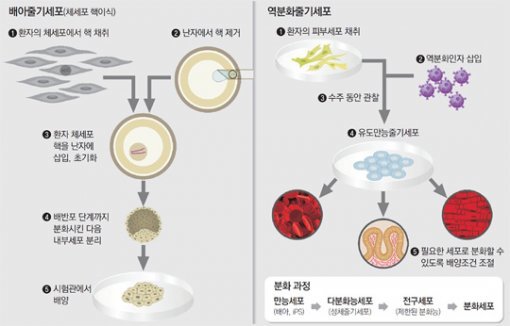
아이디어는 뛰어나지만 현실은 쉽지 않다. 우선 줄기세포 자체를 구하기 힘들다. 줄기세포는 어디에서 분리하느냐에 따라 크게 배아줄기세포와 성체줄기세포 등 두 가지로 나뉜다. 이 가운데 배아줄기세포는 말 그대로 배아에서 채취한 줄기세포로, 배아를 예비 생명체로 보는 견해로 인해 윤리적 제약이 많다. 현재는 생명윤리법 29조 1항에 따라 22개 희귀난치병 외에는 연구가 원천적으로 불가능하다. 연구를 하더라도 각 기관 자체의 생명윤리위원회(IRB)와 국가생명윤리심의위원회 등의 심의를 겹겹이 받아야 한다. 2014년 세계에서 두 번째로 체세포의 핵을 핵이 없는 난자에 넣어 배아줄기세포를 만드는 데 성공한 이동률 차의과학대 교수는 “심사를 받다 보면 7개월에서 길게는 1년이 넘게 걸릴 때도 있다”며 “긴 심사 때문에 포기한 연구 주제가 있을 정도”라고 말했다.
현재 배아를 얻는 방법은 크게 두 가지다. 체외수정을 위해 보관해 둔 배아(냉동 보관된 것도 있고 아닌 것도 있다) 가운데 남은 배아에서 직접 줄기세포를 빼는 방식이 있다. 다른 하나는 핵을 제거한 난자를 준비한 뒤 여기에 치료하고자 하는 환자의 체세포 핵을 넣어(핵이식) 일종의 융합 배아를 만드는 방식이다. 핵이식을 이용하면 환자 맞춤이 가능해 부작용이 적지만, 기술적으로 쉽지 않다. 2004, 2005년 황우석 박사가 시도하다가 성과가 나지 않자 논문 조작을 한 것이 이 기술이다. 이후 8년이 더 지난 2013년에야 슈크라트 미탈리포프 미국 오리건 보건과학대 교수팀이 성공하면서 다시 주목받고 있다.
성체줄기세포는 윤리 문제에서 비교적 자유롭다. 배아를 사용하지 않기 때문이다. 배아 시기가 지나고 나면 몸에는 줄기세포가 거의 사라진다. 다만 극히 일부가 변신하다 만 중간 형태의 줄기세포로 남아 있는데 이것이 성체줄기세포다. 피를 만드는 조혈모세포나, 골세포나 지방세포 등이 되는 중간엽세포 등이 여기에 해당한다. 이들은 변신 중간 단계이기 때문에 최종적으로 변신할 수 있는 조직의 종류에 제약이 있다. 예를 들어 신경줄기세포는 신경세포나 신경교세포 등은 될 수 있지만 뼈세포는 될 수 없는 식이다.
비록 재생시킬 수 있는 대상의 폭이 좁지만 윤리 문제에서는 자유롭고 기술적으로도 덜 까다롭기에 연구가 활발하다. 자신 또는 다른 사람의 연골에서 줄기세포를 채취해 배양한 뒤 손상된 연골에 넣어 치료하는 연골줄기세포치료제, 제대혈을 냉동했다가 그 안의 줄기세포를 치료에 이용하는 제대혈줄기세포치료제 등이 치료제로 개발됐거나 개발되고 있다. 최근 한국 미디어에 다시 얼굴을 보이기 시작한 거스 히딩크 전 축구 국가대표팀 감독이 2014년 무릎을 치료한 것도 바로 국내 업체 메디포스트가 개발한 연골줄기세포 치료제 ‘카티스템’ 덕분이었다.
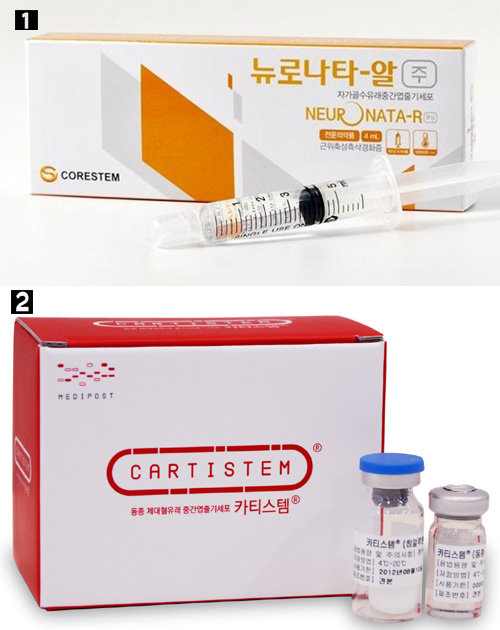
흥미로운 것은 한국에서 많은 연구자가 성체줄기세포를 연구하고 있다는 사실이다. 황우석 사태 이후 배아 관련 연구가 위축되고 규제가 엄격해지면서 연구자들이 성체줄기세포 연구로 몰렸기 때문이다. 다른 분야에 대한 연구가 필요하다는 목소리가 없지는 않다. 김정범 울산과학기술원(UNIST) 교수는 “부작용이 없다는 장점 때문에 성체줄기세포치료제 상업화가 많이 이뤄지고 있지만, 아직은 해당 조직을 보조해주는 역할을 해 일시적 효과라는 비판도 있다”고 말했다. 익명을 요구한 한 의대 교수도 “성체줄기세포치료제는 효과 측면에서 아직은 아쉬움이 있는 게 사실”이라며 “다양한 줄기세포치료 연구가 더욱 활성화돼야 한다”고 말했다.
윤신영 동아사이언스 기자 ashilla@donga.com
과학 >
이런 구독물도 추천합니다!
-

딥다이브
구독
-

밑줄 긋기
구독
-

어린이 책
구독
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개



댓글 0