美 FDA에 임상 1상 IND 접수
“근 손실 최소화·25%이상 체중 감량” 기대
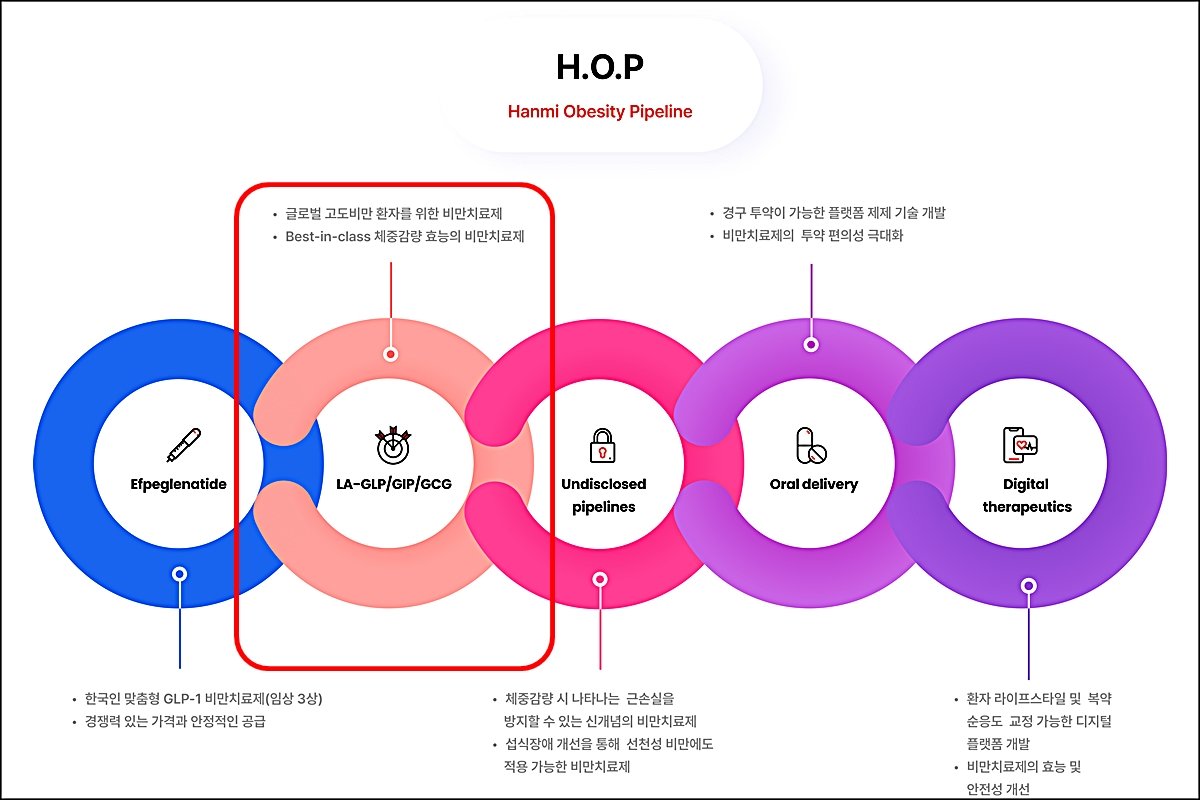
에페글레나타이드 이은 두 번째 HOP 파이프라인
오는 2030년 ‘베스트인클래스’로 상용화 목표
글로벌 비만 환자 10억 명… 2035년 19억 추산

한미약품은 미국 식품의약품(FDA)에 차세대 비만 치료 삼중작용제(HM15275) 임상 1상 시험계획(IND)을 접수했다고 1일 밝혔다.
해당 임상은 건강한 성인과 비만 환자를 대상으로 HM15275의 안전성과 내약성, 약동학, 약력학 특성 등을 평가하기 위한 연구다.
한미약품은 HM15275 상용화 목표 시점을 2030년으로 설정했다. 미국에 앞서 지난 2월 29일에는 국내 식품의약품안전처에 IND를 제출한 바 있다. HM15275는 현재 임상 3상에 들어간 에페글레나타이드 혁신을 이어나갈 차세대 비만 신약으로 기대 받고 있다. 당뇨병 치료제로 개발하던 에페글레나타이드는 2027년 출시를 목표로 국내에서 비만 환자를 대상으로 임상 3상을 진행 중이다. HM15275는 한미약품이 추진하는 ‘H.O.P' 프로젝트에서 두 번째 비만치료제 파이프라인이다.
특히 한미약품은 HM15275를 계열 내 최고신약(Best-in-class)으로 기대하고 있다. 오는 6월 미국에서 열리는 2024 미국당뇨병학회(ADA)에서 관련 주요 연구결과를 발표할 예정이다. HM15275의 잠재력과 작용 기전을 규명한 결과를 공개하고 비만이 주요 원인으로 알려진 다양한 심혈관계 질환 모델에서 차별화된 치료 효능을 입증한 결과를 발표한다.
한미약품 혁신 비만치료제는 이미 출시된 위고비나 젭바운드보다 상업화 시기가 늦지만 시장 전망은 긍정적이라는 평가다. 세계보건기구(WHO)가 최근 국제학술지 란셋(Lancet)에 게재한 보고서에 따르면 전 세계 비만 인구는 2022년 기준 10억 명 이상으로 지난 1990년과 비교해 2배 이상 늘었다. 현 추세가 유지되면 오는 2035년 세계 비만 인구는 19억 명에 달할 것으로 보고 있다. 다만 후발주자인 만큼 먼저 출시된 제품과 비교해 우위에 있는 명확한 장점을 갖춰야 시장에서 경쟁력을 유지할 수 있을 것으로 업계는 보고 있다. 2027년 출시 예정인 에페글레나타이드의 경우 한국인 맞춤형으로 개발해 치료 효과를 극대화하고 가격경쟁력도 갖출 전망이다.
최인영 한미약품 R&D센터장은 “오랜 기간 대사성 질환 분야에서 쌓아온 R&D 역량을 기반으로 전 세계적 사회 문제로 떠오르고 있는 비만 영역에서 새로운 혁신 가능성을 지속 창출해 나가고 있다”며 “제약강국을 향한 열정과 집념으로 가득 찬 한미의 R&D 혁신은 결코 멈추지 않을 것”이라고 말했다.
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개

![고립·은둔 청년 2년 새 2배, ‘그냥 쉬었음’은 역대 최대[횡설수설/우경임]](https://dimg.donga.com/a/464/260/95/1/wps/NEWS/FEED/Donga_Home_News/131211739.1.thumb.jpg)

댓글 0