국내 코로나19 치료제 개발·임상시험 진행 보고
셀트리온, 전날 임상2상 결과 발표…부작용 없어
변이 바이러스 효과 감소도…영국 등 추가 평가
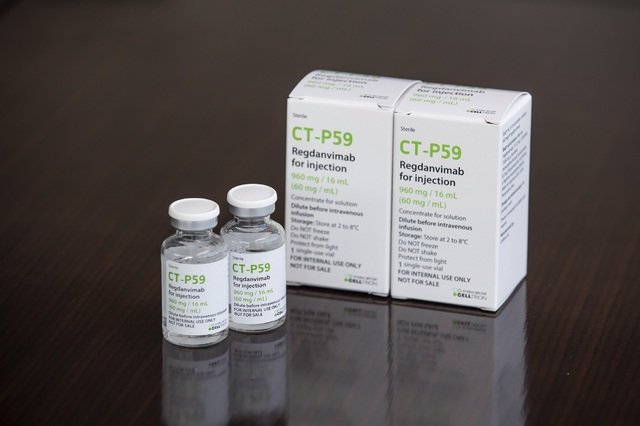
방역당국이 셀트리온 신종 코로나바이러스 감염증(코로나19) 항체치료제를 조건부 3상 임상시험 허가 전 의료진 판단에 따라 고령층·고위험 환자에게 투여하는 방안을 추진한다.
GC녹십자의 혈장치료제는 임상시험 2상을 앞두고 환자 모집을 완료했으며 대웅제약의 호이스타는 참여 환자 수를 늘려 3상 시험을 진행할 예정이다.
14일 질병관리청 중앙방역대책본부(방대본)와 국립감염병연구소에 따르면 현재 국내에서 2상 임상시험 환자 모집이 완료된 코로나19 치료제는 셀트리온 항체치료제 ‘렉키로나주’(CT-P59), GC녹십자 혈장치료제(GC5131A), 대웅제약 호이스타 등 3가지다.
―
셀트리온 항체치료제, 조건부 임상 3상 전 연구임상 추진
셀트리온의 항체치료제는 질병관리청 국립보건연구원 산하 국립감염병연구소와 셀트리온이 초기부터 공동 개발해온 치료제다.
전 임상시험에서도 코로나19 바이러스를 효과적으로 억제했다는 연구 결과가 이달 12일 국제 과학 학술지 ‘네이처 커뮤니케이션즈’에 실리기도 했다.
범정부지원위원회와 국립감염병연구소는 셀트리온 2상 임상시험의 국내 환자 모집을 행정적으로 지원했고 국립감염병연구소는 환자 검체에 대한 바이러스 배양 검사를 공동으로 진행했다.
장희창 국립감염병연구소장은 이날 방대본 정례브리핑에서 “이러한 결과에 대해서는 식품의약품안전처 심사, 논문 심사 과정에서 전문가 검증을 받는 것이 필요하다”며 “대규모 3상 임상시험을 통해 통계적으로 추가 검증이 필요하다”고 말했다.
항체치료제는 숙주 세포와 결합하는 코로나19 바이러스의 스파이크(돌기) 단백질 변이시 치료 효과가 감소할 수 있다는 우려가 있다.
이에 국립감염병연구소가 중화능력을 평가한 결과 현재까지 국내에서 유행한 바이러스 변이들에 대해선 모두 중화능력이 유지된 것으로 확인됐다. 이어 영국과 남아프리카공화국에서 발견된 변이에 대해서도 중화능력을 평가할 예정이다.
―
녹십자 혈장치료제 2상 환자 모집 완료…호이스타는 환자 늘여 3상 돌입
GC녹십자의 혈장치료제 2상 임상시험은 60명의 환자 모집이 완료된 상태다. 혈장치료제는 코로나19 완치자의 혈장에서 항체가 들어있는 면역 단백질만 걸러내 고농도로 농축해 만든 의약품이다.
또다른 치료제인 호이스타는 기존 약물을 활용한 약물재창출 치료제로 호이스타는 췌장약으로 사용됐던 약물이다. 경구투여제인 호이스타는 90명의 경증환자를 대상으로 실시한 임상시험 결과 투여군에서 임상 증상 개선이 빨랐고 체내 바이러스도 시간이 지날수록 빠르게 감소하는 경향을 보였다. 그러나 90명은 임상시험 규모로는 적은 숫자다.
장희창 소장은 “호이스타 투여군에서 임상증상이 빨리 개선되고 시간에 따라 체내 바이러스가 조금 더 빠르게 감소하는 경향성을 보였지만 임상시험 환자 수가 적었다”며 “이러한 경향이 통계적으로 유의한 것인지에 대해서는 환자 수를 늘린 3상 임상시험을 진행할 예정”이라고 말했다.
중증 환자 대상 국가임상시험 3상은 11일 주관 의료기관인 국립중앙의료원에서 개시됐다.
―
“렘데시비르 효과 있는지 국내서 직접 임상시험”
코로나19 치료제로 이날 0시 기준 110개 의료기관에서 3438명에게 공급된 렘데시비르에 대해선 그동안 효과에 대한 의문이 계속되고 있어 국내에서 별도로 임상시험을 진행키로 했다.
임상시험이 가장 많이 진행된 호이스타 외에도 중증환자 치료에 효과를 보일 수 있는 가능성이 있는 모든 약제를 대상으로 임상시험을 준비 중이다. 호이스타에 대해서는 지난해 12월31일 중증환자에 대한 임상시험에 대한 식약처 승인이 이뤄졌고 주관 의료기관인 국립중앙의료원에서 진행하는 것으로 계획 중이지만 현재 여러 가지 세부사항을 협의 중이다.
중앙임상위원회와 대한감염학회를 통해 코로나19 치료 지침이 개정되면서 하이드록시클로로퀸, 칼레트라 등은 치료에 효과가 없는 것으로 증명됐다. 스테로이드 제제인 덱사메타손은 경증환자 투여시 사망률을 높일 수 있다는 연구 결과가 나왔다.
장희창 소장은 “현재 치료를 담당하고 있는 의료진과 환자분들께는 하이드록시클로로퀸, 칼레트라 같은 효과가 없는 것으로 증명된 약제는 더 이상 사용하지 않기로 요청한다”며 “산소투여가 필요하지 않은 경증환자에서 덱사메타손과 같은 스테로이드 제제를 투여하는 것은 오히려 사망률을 높인다는 결과가 나왔기 때문에 경증환자에서는 스테로이드를 투여하지 말아 달라”고 말했다.
[서울=뉴시스]
코로나 재확산 >
구독
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개



댓글 0