미국 노바백스 백신의 미국 긴급사용승인 신청이 3분기로 지연됐지만 국내 방역당국은 해당 백신의 국내 도입에 차질이 없을 것으로 전망했다.
앞서 정부는 오는 3분기 2000만회분(1000만명분) 그리고 4분기에 2000만회분의 노바백스 백신을 도입할 예정이라고 밝혔다. 백신의 국내 허가를 담당하는 식품의약국안전처는 현재 영국·유럽처럼 노바백스 백신에 대한 사전 심사를 진행하고 있어 허가 시기가 늦어지는 것을 최대한 방지하겠다는 입장이다.
◇FDA 승인신청, 임상결과 분석 지연으로 3분기로 연기
노바백스는 당초 상반기 중 미국 내 승인을 받아 오는 3분기부터 매달 1억5000만회분을 생산할 계획이었다. 하지만 허가신청 지연으로 백신 공급 일정도 다소 미뤄질 전망이다. 노바백스 측이 4분기는 돼야 매달 1억5000만회분 생산 목표 달성이 가능할 것으로 전망했기 때문이다.
노바백스는 지난 1월 영국에서 1만5000명을 대상으로 진행한 임상시험에서 89.3%의 예방 효과를 확인했다. 또한 미국과 멕시코에서 3만명을 대상으로 실시한 임상3상 결과가 조만간 나올 것으로 예상됐으나 그 시기가 3분기로 늦어진 것이다.
CNN은 노바백스가 영국 의약품건강관리제품규제청(MHRA)과 유럽의약품청(EMA)에도 오는 3분기 중 긴급사용 승인을 신청할 계획이라고 전했다. 현재는 양 기관 모두 사전 검토(rolling review)가 진행 중이다.
노바백스의 미국 내 허가 지연에도 우리 방역당국은 백신 도입 계획에는 변화가 없을 것이라는 입장이다.
김기남 코로나19 예방접종대응추진단 예방접종관리반장은 11일 코로나19 중앙방역대책본부 정례브리핑에서 “식약처에서 허가절차를 다른 주요국과 병행해서 준비를 하고 있고, 관련 자료를 사전 검토를 진행하고 있다”며 “현재로서는 정부의 백신 도입 계획에는 변화가 없는 상황”이라고 말했다.
일각에서는 노바백스가 미국과 유럽 등 사용신청 시기를 늦춘 이유로 원재료와 장비 확보 탓이라는 분석이 나온다. 이에 3분기 내 2000만회분 도입에 영향이 있을지에 대한 질문에 방역당국은 “현재까지는 변화가 없고 국제적 동향과 국내 생산을 모니터링하고 있다”고 답변했다.
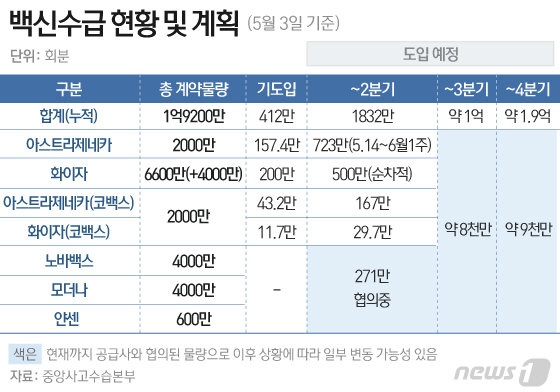
한편 정부는 올 상반기까지 코로나19 백신 1832만회분 도입을 확정했고, 추가로 얀센·노바백스·모더나 백신 271만회분 도입을 협의중이다. 다만 추가 도입분 271만회분 중 노바백스 백신 도입은 어려울 것으로 전망된다.
국내에서 노바백스를 생산하는 SK바이오사이언스 또한 노바백스 백신 생산 계획에 변동이 없다는 반응이다.
SK바이오사이언스 측 관계자는 “국내에서도 허가가 돼야 공급이 가능한 만큼 허가 일정을 지켜보겠지만 현재까지 생산일정에 큰 변화는 없다”고 밝혔다.
SK바이오사이언스는 이미 해당 백신 생산을 시작해 식약처에서 허가가 나는 대로 공급을 시작할 것으로 보인다.
식약처 또한 아직까지는 노바백스 백신의 품목허가 일정이 정상적으로 진행되고 있다는 입장이다. 식약처는 지난 4월 29일부터 비임상 및 임상1·2상 결과에 대해 사전검토에 들어가 심사를 진행 중이다.
식약처 측 관계자는 “현재 롤링리뷰가 진행중인 영국이나 유럽과 병행해서 허가자료를 제출받을 수 있도록 논의 중”이라며 “(노바백스의 품목허가) 신청시기는 단언할 수 없지만 유럽, 영국과 비슷한 시기에 (허가가) 이루어지지 않을까 생각한다”고 말했다.
영국·유럽과 비슷하게 자료를 받아 3분기 초부터 심사가 이루어질 경우 지난달 정부가 공언했던 것처럼 3분기 안으로 노바백스 백신 공급이 가능할 전망이다.
식약처는 코로나19 백신에 대해 신속승인 절차를 적용해 최대 40일 이내에 심사를 마친다는 입장이다. 따라서 3분기 초부터 심시가 이루어질 경우 약 20일간의 국가출하승인 기간을 더하더라도 8월말이나 9월 초에는 노바백스 백신 공급이 가능할 전망이다.
(서울=뉴스1)
코로나 재확산 >
구독
-
- 좋아요
- 0개
-
- 슬퍼요
- 0개
-
- 화나요
- 0개
![‘코로나19’ 5년… 트럼프도 인정한 드라이브스루 검사를 기억하시나요[유레카 모멘트]](https://dimg.donga.com/a/180/101/95/2/wps/NEWS/IMAGE/2025/03/16/131212749.1.jpg)



댓글 0